有如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.
 有如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.
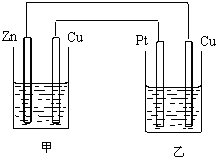
有如图所示的装置,甲装置中的电解质溶液为硫酸铜溶液,乙中为稀硫酸,请按以下要求回答问题.(1)甲装置是______(原电池或电解池),写出甲中铜电极上的电极反应为______.
(2)乙装置中铜电极做______极,在该电极上的电极反应为______,铂电极上的电极反应为______.
(3)反应开始一段时间后,甲中锌极质量减少6.5克,此时乙中两极收集到的气体在标准状况下的总体积______L.
共回答了78个问题采纳率:86.4%
(2)以中铜为阴极、Pt作阳极,阴极上氢离子放电、阳极上氢氧根离子放电;
(3)根据转移电子相等计算生成气体体积.
(1)甲装置能自发的进行氧化还原反应,且符合原电池构成条件,所以甲是原电池,则乙是电解池,甲中锌易失电子作负极、铜作正极,Cu电极上铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu,故答案为:原电池;Cu2++2e-=Cu;
(2)以中铜为阴极、Pt作阳极,阴极上氢离子放电,电极反应式为2H++2e-=H2↑,阳极上氢氧根离子放电,电极反应式为4OH--4e-=O2↑+2H2O,故答案为:阴;2H++2e-=H2↑;4OH--4e-=O2↑+2H2O;
(3)反应开始一段时间后,甲中锌极质量减少6.5克,转移电子的物质的量=[6.5g/65g/mol]×2=0.2mol,阳极上生成气体体积=
0.2mol
4×22.4L/mol=1.12L,根据转移电子相等知,阴极上生成气体体积=
0.2mol
2×22.4L/mol=2.24L,所以乙中析出气体体积为3.36L,故答案为:3.36.
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池和电解池原理,先根据能否自发进行氧化还原反应确定原电池和电解池,再结合离子放电顺序、转移电子相等进行解答,难点是电极反应式的书写,题目难度不大.
-
You can go with us,or you can stay here.You can _____go with
2024-04-2912个回答
-
How about going camping with us this weekend?
2024-04-297个回答
-
i can't go camping with you ( )Monday afternoon,I can go wit
2024-04-292个回答
-
适当形式填空说明为什么1would you like to go(camp)with us john2thouse(vi
2024-04-291个回答
-
what a p .you can't go camping with us tomorrow
2024-04-293个回答
-
相似题的题目相似三角形题目:1.操作如图,在正方形ABCD中,P是CD上一动点(与C、D不重合).使得三角形的直角顶点与
2024-04-291个回答
-
Would you like to go camping with us this weekend?
2024-04-295个回答
-
已知如图在正方形ABCD中E是CD上的点BF平分角ABEF在AD上求证BE=AF+CE
2024-04-291个回答
-
如图,正方形ABCD中,E在CD上,F在CB的延长线上,DE等于BF,连EF,EM平分角CEF交AC于M
2024-04-291个回答
-
如图,正方形ABCD,点M在CD上,在AC上确定点N,是DN+MN最小
2024-04-292个回答
-
如图,点M,N分别在正方形ABCD的边BC,CD上,已知三角形MCN的周长等于正方形ABCD周长的一半,求角MAN的度数
2024-04-291个回答
-
在一个三位数的百位数字与十位数字之间插入0,1,2,…,9中的一个数码得到的四位数恰是原三位数的9倍,求这样的三位数中最
2024-04-291个回答
-
已知正方形ABCD,点E在CD上,以CE为边向外作正方形CEFG,点P在BC上,且∠FAP=45°,求证:AF=√2AP
2024-04-291个回答
-
在3张卡片上分别写有3、5、7这3个数字中的一个,可以组成一位数、两位数和三位数,其中质数的个数是 个.
2024-04-291个回答
-
将-18,-15,-12,-9,-6,-3,0,3,6填一个大方格中9个小方格使大方格横竖斜对角三数字之和都相等.
2024-04-291个回答
-
小明家准备用15000元装修房子,新房的使用面积包括居室、客厅、卫生间和厨房共100m2,卫生间和厨房共10m2,厨房和
2024-04-291个回答
-
下列图中每一个小方格填入一个整数,并且使任意三个相邻格中所填数之和都等于5,则X+Y+Z=
2024-04-293个回答
-
2024-04-291个回答
-
2024-04-296个回答
-
2024-04-292个回答
你能帮帮他们吗
-
求因式分解解题思路为什么1+2a^2-3a=(2a-1)(a-1)不管怎么算我都算不出啊,没公因式,没公式可以套,十字分
2024-04-271个回答
-
cosx/2*cosx/4*cosx/8.*cosx/2的n次方
2024-04-272个回答
-
初速度为零的自由落体 下落20m 用公式h=1/2 gt^2 可以算出走20m用2s
2024-04-271个回答
-
一张长方形纸片长8厘米,宽6厘米,把它剪成一个最大的正方形,剪去部分的面积是______.
2024-04-271个回答
-
三相异步电动机一般几极对数?是用这个公式N=60F/P(1-S)算电机转速吗?如果可以 这个公式能算出 变频器频率在40
2024-04-271个回答
精彩回答
-
2024-04-302个回答
-
下列说法中正确的是( )A. 物体在发生物态变化时都要吸热B. 热量总是自发地从高温物体传给低温物体C. 物质的比热容
2024-04-302个回答
-
已知4X的平方+Y的平方-4X-6Y+10=0,求2/3x根号9X+9Y的平方根号X/Y的平方-(X的平方根号1/X-5
2024-04-305个回答
-
2x的平方+xy=10,3y的平方+2xy=6,求4x的平方+9y的平方的值
2024-04-302个回答
-
南极洲跨经度最广,那南极洲到底跨了多少经度,最东端和最西端的经度分别是多少?亚洲(最东端为东经26度,最西端为西经170
2024-04-302个回答
